下列分子中,不是正四面体结构的是( )。
正确答案:
C
答案解析:
【解析】选项(B)P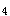 中的每个P原子都是完全相同的,都应该是不等性sp
中的每个P原子都是完全相同的,都应该是不等性sp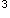 杂化.每一个P原子都以sp
杂化.每一个P原子都以sp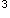 杂化轨道与其他三个P原子形成共价键,因此,四个P原子分布在一个正四面体的四个顶点上而形成了正四面体结构。选项(A)、(C)、(D)的中心原子C和N都是等性sp
杂化轨道与其他三个P原子形成共价键,因此,四个P原子分布在一个正四面体的四个顶点上而形成了正四面体结构。选项(A)、(C)、(D)的中心原子C和N都是等性sp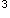 杂化,杂化轨道在空间呈正四面体分布,(A)和(D)的中心原子所键合的原子都是相同原子,因此形成了正四面体分子结构,但(C)的中心原子所键合的原子并不相同,因此,形成了变形四面体分子结构,故(C)是正确答案。
杂化,杂化轨道在空间呈正四面体分布,(A)和(D)的中心原子所键合的原子都是相同原子,因此形成了正四面体分子结构,但(C)的中心原子所键合的原子并不相同,因此,形成了变形四面体分子结构,故(C)是正确答案。
【点评】共价分子的空间结构经常用杂化轨道理论来判断,其要点是:
(1)在分子中,若一个原子键合了两个或两个以上的原子,则被称为中心原子,原子轨道杂化就发生在中心原子上;
(2)中心原子中参与杂化的原子轨道的个数,也就是能够形成杂化轨道的个数,等于分子中中心原子周围所形成σ键的数目与中心原子上的孤电子对数之和。分子中中心原子周围所形成σ键的数目就是其键合的原子数目,再根据中心原子的结构,找出其价电子数(要根据中心原子所带的电荷进行调整,每带一个正电荷,减去一个价电子;每带一个负电荷,加上一个价电子),减去分子中中心原子形成共价键所用掉的价电子数,再除以2,就可以得到中心原子上的孤电子对数。
(3)杂化轨道在空间的分布遵循"斥力最小原则",据此可以确定杂化轨道在空间的分布方式。
(4)根据分子中中心原子所键合原子的种类和个数,结合杂化轨道在空间的具体分布,就可以判断出共价分子的空间结构。因每形成一个共价键(含丌键)就会用掉一个价电子,因此可以同时判断出中心原子上是否有孤电子对,以及有几个孤电子对。
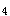 中的每个P原子都是完全相同的,都应该是不等性sp
中的每个P原子都是完全相同的,都应该是不等性sp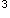 杂化.每一个P原子都以sp
杂化.每一个P原子都以sp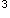 杂化轨道与其他三个P原子形成共价键,因此,四个P原子分布在一个正四面体的四个顶点上而形成了正四面体结构。选项(A)、(C)、(D)的中心原子C和N都是等性sp
杂化轨道与其他三个P原子形成共价键,因此,四个P原子分布在一个正四面体的四个顶点上而形成了正四面体结构。选项(A)、(C)、(D)的中心原子C和N都是等性sp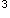 杂化,杂化轨道在空间呈正四面体分布,(A)和(D)的中心原子所键合的原子都是相同原子,因此形成了正四面体分子结构,但(C)的中心原子所键合的原子并不相同,因此,形成了变形四面体分子结构,故(C)是正确答案。
杂化,杂化轨道在空间呈正四面体分布,(A)和(D)的中心原子所键合的原子都是相同原子,因此形成了正四面体分子结构,但(C)的中心原子所键合的原子并不相同,因此,形成了变形四面体分子结构,故(C)是正确答案。【点评】共价分子的空间结构经常用杂化轨道理论来判断,其要点是:
(1)在分子中,若一个原子键合了两个或两个以上的原子,则被称为中心原子,原子轨道杂化就发生在中心原子上;
(2)中心原子中参与杂化的原子轨道的个数,也就是能够形成杂化轨道的个数,等于分子中中心原子周围所形成σ键的数目与中心原子上的孤电子对数之和。分子中中心原子周围所形成σ键的数目就是其键合的原子数目,再根据中心原子的结构,找出其价电子数(要根据中心原子所带的电荷进行调整,每带一个正电荷,减去一个价电子;每带一个负电荷,加上一个价电子),减去分子中中心原子形成共价键所用掉的价电子数,再除以2,就可以得到中心原子上的孤电子对数。
(3)杂化轨道在空间的分布遵循"斥力最小原则",据此可以确定杂化轨道在空间的分布方式。
(4)根据分子中中心原子所键合原子的种类和个数,结合杂化轨道在空间的具体分布,就可以判断出共价分子的空间结构。因每形成一个共价键(含丌键)就会用掉一个价电子,因此可以同时判断出中心原子上是否有孤电子对,以及有几个孤电子对。
 Cl
Cl
